Lattoferrina e Cavo orale
Cavità orale: microbiota, saliva, lattoferrina, infiammazioni ed infezioni
Il corpo umano è formato da 10(13) cellule eucariote (cellule umane) e da 10(14) cellule procariote (batteri). Questi batteri, perenni ospiti, svolgono molte funzioni biologiche che l’uomo, di per sé, non sarebbe in grado di
svolgere e lo proteggono dall’aggressione dei microorganismi patogeni. Nell’uomo, infatti, tutte le mucose, incluse quelle orali, sono colonizzate da microorganismi commensali (non patogeni) che svolgono un’azione protettiva nei confronti dell’instaurarsi di infezioni da parte dei microorganismi patogeni (fig. 1).
Per microbiota orale si intende, quindi, l’insieme di microorganismi commensali che colonizzano il cavo orale (1).
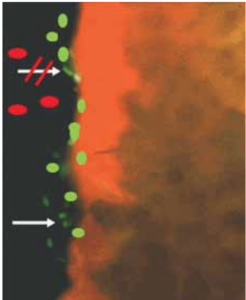
da batteri commensali (verdi) che
impediscono la colonizzazione dei
batteri patogeni (rosso).
In alcune situazioni, i microorganismi commensali possono divenire patogeni occasionali, iniziando così episodi infettivi endogeni. Tuttavia, le patologie orali possono instaurarsi anche a seguito di infezioni da parte di patogeni esogeni (esterni).
D’altra parte, il cavo orale è facilmente accessibile ai microorganismi presenti nell’aria, nell’acqua, nei cibi e in altri distretti del corpo, come le mani. Alcuni di questi microorganismi sono presenti nel cavo orale in forma transiente (vedi Helicobacter pylori), mentre altri lo colonizzano stabilmente (2).
Basti pensare che in 1 ml di saliva ci sono 500 milioni di batteri ed in 1 g di placca da 10(10) a 10(11) microorganismi. L’elevato numero di microorganismi presenti nel cavo orale è anche dovuto al fatto che, oltre alle mucose, nel cavo orale sono presenti superfici abiotiche rappresentate dai denti che, a loro volta, forniscono un importante sito di colonizzazione microbica (3). Infatti, i denti sono ricoperti da uno strato di mucoproteine salivari (proteine e glicoproteine salivari come il lisozima, la lattoferrina, la lattoperossidasi e le immuno-globuline secretorie) che costituiscono la pellicola acquisita. La pellicola salivare acquisita si forma molto rapidamente sulle superfici dentarie e, una volta rimossa con lo spazzolino, si riforma aumentando di dimensioni fino a che in circa 30 minuti raggiunge dimensioni stabili. La pellicola acquisita favorisce la colonizzazione immediata da parte dei microorganismi presenti nel cavo orale come Streptococcus mutans, S. salivarius, S. mitis, S. oralis, S. sanguinis e S. gordonii, Spirilli, Lactobacilli, Actinomiceti eccetera, che formano la placca dentale (fig. 2).
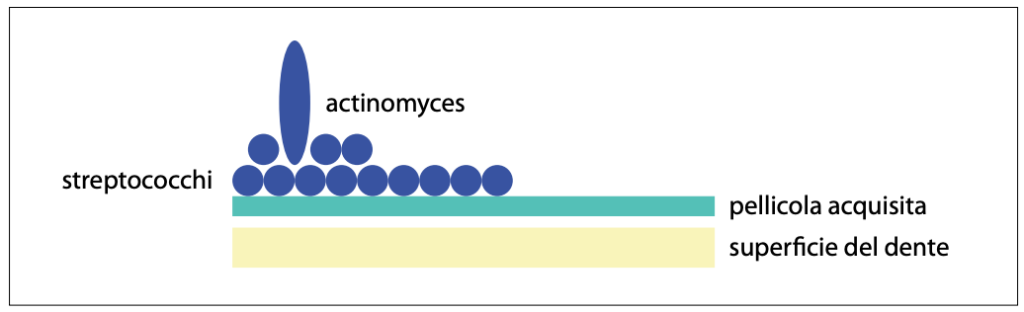
La placca batterica, costituita da batteri aggregati e adesi tra loro e alle superfici dentali può essere sopra e sottogengivale (fig. 3).
batterica nella placca dentale
sopra e sottogengivale.
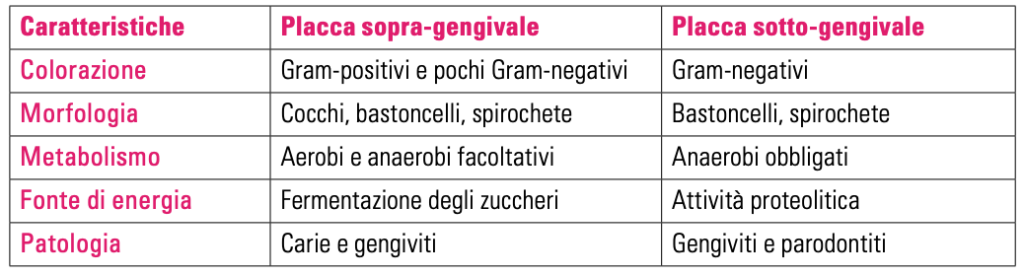
Esistono delle importanti differenze tra la placca sopragengivale e quella sottogengivale, riportate nella tabella 1.
La placca, adesa alla superficie dentale, disgrega lo smalto attraverso la sintesi di acido lattico e pirofosfatasi che aggrediscono l’idrossiapatite, mentre attraverso le aminopeptidasi viene distrutta la componente proteica interprismatica dello smalto.
Iniziano così le fasi precoci della formazione della carie, con
un’espansione orizzontale maggiore di quella verticale, poiché
lo smalto è particolarmente duro.
Successivamente al danneggiamento dello smalto, i batteri raggiungono la dentina, che viene rapidamente demineralizzata, e poi possono colonizzare la polpa del dente, causando processi infiammatori. Pertanto, la carie non è altro che una distruzione localizzata dei tessuti duri del dente suscettibili all’azione dei prodotti acidi del metabolismo batterico derivanti dagli zuccheri della dieta. La successiva deposizione di sali di calcio e di fosfati nella placca trasforma quest’ultima in tartaro.
La cavità orale è quindi un sistema aperto in cui i microorganismi e le sostanze nutritive vengono continuamente immesse e rimosse. L’equilibrio dinamico dell’ecosistema orale è influenzato dall’assunzione di cibo la cui composizione influenza il microbiota orale. In particolare, bevande o cibi ad elevato contenuto di carboidrati influenzano la crescita ed il metabolismo di Streptococcus sobrinus e Streptococcus mutans ampiamente presenti nella placca sopragengivale. Entrambe queste specie, definite fermentanti, utilizzano i carboidrati producendo, come già
riportato, acido lattico che, abbassando il pH della saliva, favorisce la formazione delle carie il cui andamento evolutivo è riportato nella figura 4.
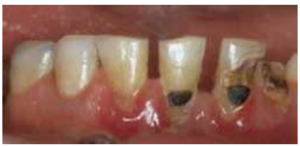
alla dentina.
Per ciò che concerne l’identificazione dei vari generi e specie che colonizzano il cavo orale, esiste una notevole discrepanza tra il numero dei batteri contati al microscopio e quelli coltivabili e contati mediante la conta delle unità formanti colonia.
Evidentemente, esistono ancora molti microorganismi che, pur essendo vitali, non siamo in grado di coltivare.
Infatti, delle 700 specie procariotiche presenti nella cavità orale,
circa il 49% sono ufficialmente riconosciute, il 17% non sono ancora state classificate ed il 34% non sono coltivabili (4).
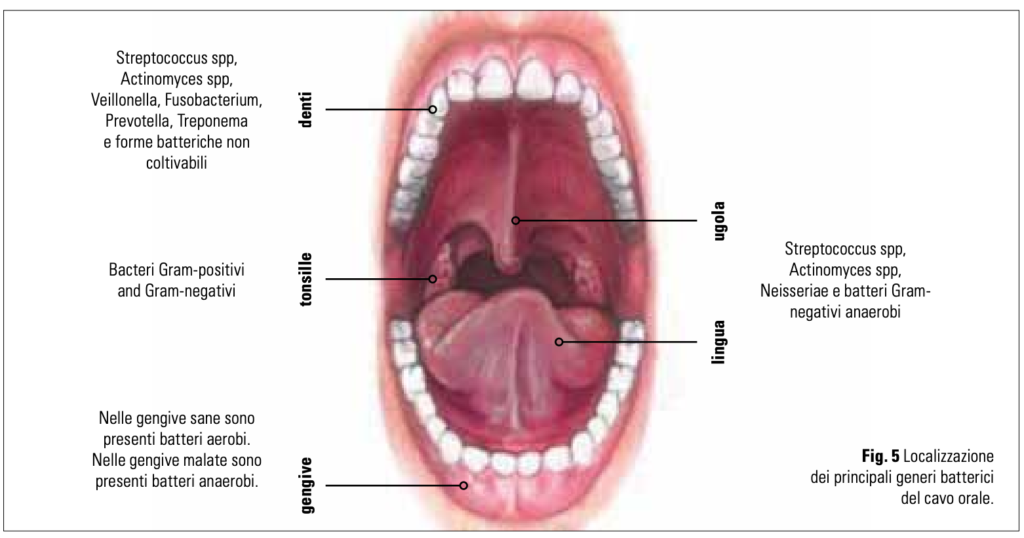
Inoltre, la colonizzazione del cavo orale è estremamente specifica per ciascuna sede, così che la bocca va vista come un complesso di microcosmi biologici. In ognuno di essi è possibile identificare una comunità microbica differente, più o meno stabile nel tempo, in continua interazione con l’esterno e dipendente dalla disponibilità di ossigeno che diminuisce nei casi in cui la placca sopragengivale non venga rimossa a causa di una scarsa o inadeguata igiene orale (fig. 5).
Inoltre, generalmente i batteri della placca, oltre che aderire alla superficie del dente, sintetizzano un proprio polisaccaride extracellulare che li ricopre formando il così detto biofilm.
Per ciò che riguarda i miceti, pur essendo Candida albicans un componente del microbiota orale nell’uomo, può sviluppare infezioni in soggetti immunocompromessi quali anziani, diabetici, soggetti affetti da HIV, da cancro, soggetti sottoposti a prolungate terapie antibiotiche o antitumorali.
Un’importante linea di difesa contro la candidiasi è rappresentata dal microbiota orale e da alcuni componenti antimicotici della saliva. Ovviamente, i casi di patologie orali da Candida albicans indicano una disbiosi microbica, una disfunzione salivare ed un danno degli epiteli.
Candida albicans è stata inoltre isolata in pazienti affetti da parodontiti associate a disordini delle difese naturali e a fenomeni infiammatori.
Complessità del Micobiota Orale
I microorganismi più frequentemente isolati all’interno del microbiota orale in soggetti sani sono: Streptococcus, Actinomyces,
Veillonella parvula e V. alcalescens, Fusobacterium, Porphiromonas, Prevotella, Treponema, Actinobacillus/Aggregatibacter actinomycetemcomitans, Nisseria flavescens, Haemophilus, Fusobacterium nucleatum, Eubacteria, Lactobacillus, Treponem denticola, T. macrodentium, T. orale, Capnocytophaga, Eikenella,
Leptotrichia, Peptostreptococcus, Staphylococcus e Propionibacterium (4).
Occorre sottolineare che tra questi, i più importanti batteri
Gram-negativi come Porphyromonas gingivalis, Prevotella intermedia, Fusobacterium nucleatum, Actinobacillus/Aggregatibacter actinomycetemcomitans, Treponema denticola, T. macrodentium, T. orale, Neisseria flavescens, Veillonella parvula e V. alcalescens sono
anaerobi intracellulari facoltativi che migrano dalla placca sopragengivale e colonizzano la placca sottogengivale, provocando fenomeni patologici a carico del parodonto. Similmente alla Candida albicans, alcuni batteri patogeni superano la risposta immune dell’ospite formando un biofilm misto che consiste di commensali e patogeni (5). Infatti, anche i commensali si adattano ai cambiamenti ambientali e interagiscono con altre specie microbiche aggregandosi in biofilm.
L’adesione microbica e la successiva formazione del biofilm avviene non solo sulla superficie dentale, ma anche su resine per uso odontoiatrico (fig. 6), sulle cellule epiteliali a livello della mucosa orale (fig. 7), sulle protesi e apparecchi ortodontici (4, 6).

per uso odontoiatrico (B). Resina sterile (A). (13).
Dalla fig. 7 appare chiaramente come batteri in biofilm possono essere adesi anche a cellule epiteliali a livello della mucosa e
pertanto in soggetti edentuli possono essere presenti e provocare infezioni anche severe (7).
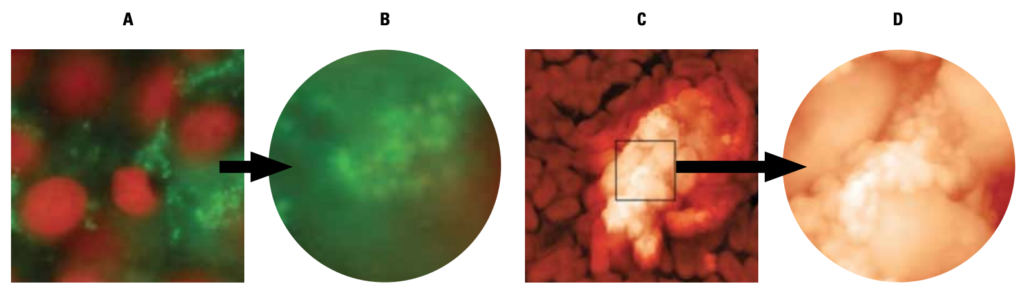
della mucosa buccale.
A e B: immagini al microscopio a fluorescenza;
C e D: immagini al microscopio atomico.
A: batteri adesi a cellule
B: batteri ricoperti da esopolisaccaride (biofilm)
C: batteri con iniziale biofilm
D: batteri ricoperti totalmente
da esopolisaccaride.
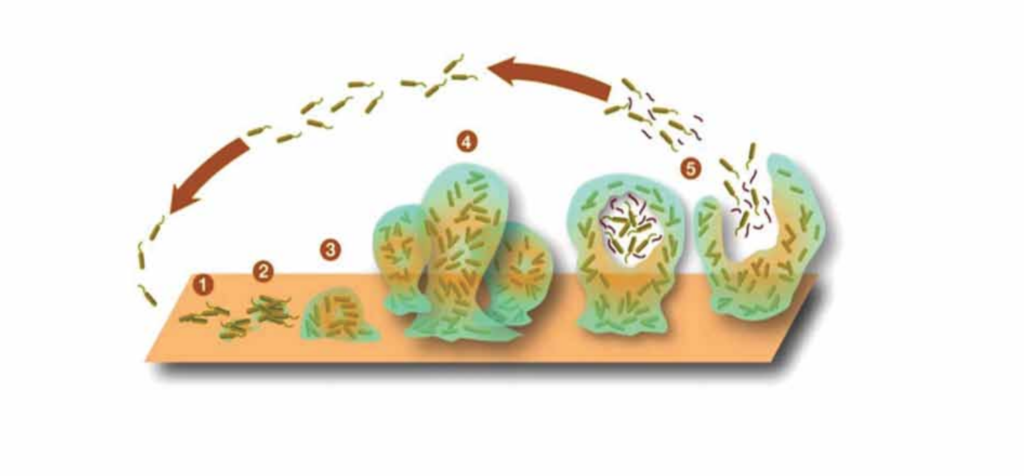
Occorre sottolineare che la formazione del biofilm avviene attraverso cinque fasi specifiche:
- adesione reversibile dei batteri (definiti primi colonizzatori) ad una superficie
abiotica (denti, protesi, impianti) o cellulare attraverso interazioni elettrostatiche,
forze di Coulomb e di van Der Waals; - adesione irreversibile tra le adesine batteriche e le proteine dell’ospite;
- replicazione e colonizzazione della superficie;
- sintesi di un esopolisaccaride che ricopre la comunità microbica pura o mista;
- rilascio dal biofilm dei batteri in forma planctonica.
Nel microbiota orale i primi colonizzatori sono gli Streptococchi.
I microorganismi che colonizzano la cavità orale, sviluppandosi
in biofilm, sono difficili da eradicare e possono causare numerose malattie infettive incluse la carie, la gengivite, la parodontite, le infezioni del canale radicolare e l’osteite alveolare.
Recentemente, sta emergendo come alcuni batteri che colonizzano il cavo orale siano associati a severe patologie. Infatti, è stato dimostrato che S. mutans è un batterio intracellulare facoltativo in grado di penetrare all’interno delle cellule dell’ospite (8). Questa caratteristica può rendere ragione del fatto che S. mutans è anche l’agente eziologico di patologie più severe come le endocarditi.
Anche le parodontopatie sono state associate a patologie cardiovascolari (9), ad insulti cerebrovascolari (10) ed ad un alto rischio di parti pretermine (11).
In aggiunta, è stato dimostrato un alto grado di associazione tra
il diabete mellito e la malattia parodontale.
Questa correlazione è bidirezionale con la parodontite che mostra
un effetto negativo verso il diabete mellito e viceversa (12).
In senso più generale, le infezioni del parodonto che sembrano essere associate ad altre patologie caratterizzate dall’infiammazione cronica saranno descritte in dettaglio in un successivo articolo (Lattoferrina e parodontopatie).
Tuttavia, anche se l’eziologia di questa associazione tra parodontopatie e alcune patologie è ancora da chiarire, i disordini infiammatori, differentemente causati, provocano l’aumento della severità di svariate patologie.
In sintesi, le infezioni delle mucose orali sono regolate da meccanismi diversi da quelli delle infezioni dei fluidi biologici inclusi il sangue ed il liquor ed anche di quelle che colonizzano gli organi.
Lo strato mucoso è quindi in grado i riconoscere i batteri commensali come “amici protettivi” ed i batteri patogeni come “dannosi nemici”. Infatti, se le mucose non riconoscessero l’utilità dei batteri commensali, sarebbero sempre danneggiate da processi infiammatori.
Inoltre, le mucose orali nella loro azione di barriera protettiva
contro le infezioni sono sempre coadiuvate dai componenti della saliva.
La saliva
Recentemente, l’analisi della saliva viene considerata un saggio
non invasivo per monitorare lo stato di salute e per prevenire lo
stato patologico di un soggetto (14).
Tuttavia, occorre seguire con attenzione le linee guida specifiche, prima di procedere alla raccolta dei campioni di saliva, al fine di minimizzare eventuali errori (15). In particolare, cibi e bevande non devono essere assunti almeno 2 ore prima del prelievo e le bevande alcooliche 24 ore prima, al fine di evitare la non attendibilità e la non ripetibilità dei risultati (16).
La saliva è stata ampiamente studiata essendo necessaria al mantenimento della salute orale grazie ai numerosi fattori di difesa naturale che la compongono. In un soggetto sano, ogni giorno vengono prodotti da 1.000 a 1.500 ml di saliva che vengono ingoiati ed i cui componenti vengono assorbiti a livello intestinale. Come le altre secrezioni umane, la saliva è prodotta da ghiandole esocrine come le salivari che includono le parotidi, le
ghiandole sublinguali e sottomascellari. Essa è composta da ormoni, peptidi, composti inorganici (Fe3+, Mg2+, Na+ , K, Ca2+, Cl−, HPO4 2− e HCO3−), composti organici e vari enzimi (17).
Gli ormoni steroidei della saliva comprendono il cortisolo, il testosterone, il
deidroepiandrosterone, gli estrogeni, il progesterone e l’aldosterone. È ricca anche di sostanze antibatteriche come la lattoferrina (Lf), il lisozima, le mucine (MG1 e MG2), le IgA, IgM, IgG, l’alfa-amilasi e composti organici come l’albumina, l’urea, gli acidi urici, i lattati e la creatinina (17). La Lf , una glicoproteina in grado di chelare due atomi di ferro per molecola (vedi i dettagli nella prossima sezione), è il più importante fattore dell’immunità
naturale della saliva che protegge i tessuti dall’aggressione di batteri, miceti e virus patogeni (18). Differentemente dalla mucina salivare (MG2), che è riportata possedere un’attività candicida e battericida verso Aggregatibacter actinomycetemcomitans (19, 20, 21), la Lf salivare, oltre ad avere un’attività antimicrobica dovuta alla sua capacità di legare due atomi di ferro per molecola sottraendolo ai batteri patogeni, possiede anche una potente attività antiinfiammatoria dimostrata in vitro (22) ed in vivo (23,
24, 25, 26).
La saliva contiene circa 20 µg/ml di Lf mentre altri fluidi come
quello crevicolare ne contengono 1,23 µg/ml (27).
È stato, inoltre, dimostrato che i livelli di Lf e MG2 sono alterati nei soggetti affetti da patologie orali (27, 28). Queste alterazioni, ma soprattutto la diminuzione della concentrazione di MG2 e di Lf, sono particolarmente importanti. In particolare, la diminuzione della concentrazione di Lf è molto rilevante per l’insorgenza di processi infiammatori patologici che, è ormai assodato, sono associati a tutte le patologie infettive del cavo orale (26).
L’infiammazione patologica distruttiva, dovuta in parte alla carenza di Lf nella saliva, è indotta anche da vari fattori come il sovraccarico di ferro libero e disponibile (circa 100 µM) nella saliva e nelle cellule. L’eccesso di ferro libero, dovuto anche alla carenza di Lf, stimola la moltiplicazione microbica, la sintesi di radicali tossici dell’ossigeno (ROS), i processi infiammatori, la formazione di pigmenti e l’insorgenza del black stain (13,
18, 29).
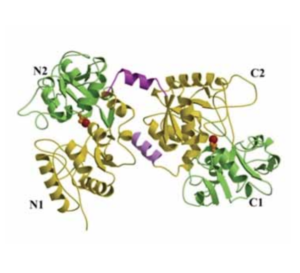
della lattoferrina (30).
Per ciò che riguarda la concentrazione di ferro libero nella saliva, essa oscilla in situazioni fisiologiche tra 0,1 e 1,0 µM, a seconda che l’analisi sia eseguita prima o dopo i pasti, mentre in situazioni patologiche raggiunge concentrazioni significativamente maggiori (13). L’aumento patologico del ferro libero intra ed extracellulare è conseguente ai disordini nell’omeostasi del ferro: sovraccarico di ferro nei tessuti e secrezioni e carenza di
ferro in circolo (anemia da carenza di ferro). I dettagli nella seguente sezione.
Inoltre, va menzionato che le analisi del contenuto di ferro nella saliva, riportate in letteratura, sono riferibili al ferro totale e non distinguono mai la concentrazione di ferro libero da quello emico derivante dal sanguinamento (degradazione dell’emoglobina), importante fattore di crescita e di virulenza dei batteri patogeni anaerobi, associati alle parodontopatie.
La Lattoferrina
La lattoferrina (Lf), una glicoproteina di 80-kDa appartenente alla famiglia delle transferrine, è il piu’ importante componente delle secrezioni umane inclusa la saliva. Lf è sintetizzata costitutivamente dalle ghiandole esocrine incluse le salivari, mentre è indotta nei neutrofili richiamati nei siti d’infezione ed infiammazione (18). Lf contiene 691 amino-acidi ed è divisa in due omologhi lobi (lobo N e Lobo C) connessi da 3 alfa-eliche e contenenti ciascuno un sito di legame per lo ione ferrico (30) (fig. 9).
La Lf, inoltre, è altamente conservata nelle specie umana, bovina, porcina e murina e tutte le Lf sono in grado di chelare due ioni ferrici per molecola con alta affinità (Kd ~ 10−20 M). Il legame tra gli ioni ferrici e la Lf persiste fino a valori di pH prossimi a 3.0 (tipici dei siti d’infezione e infiammazione), mentre la transferrina (Tf), tipica proteina di trasporto, cede il ferro già a pH prossimo a 6.0 (18, 26).
L’affinità per gli ioni ferrici della Lf nelle secrezioni o della Tf nel circolo è così elevata da garantire che la concentrazione di ferro libero nel corpo non ecceda la concentrazione di 10-18 M, impedendo così la precipitazione di questo metallo come idrossido insolubile, la moltiplicazione microbica, la formazione di specie reattive dell’ossigeno e i conseguenti processi infiammatori (18).
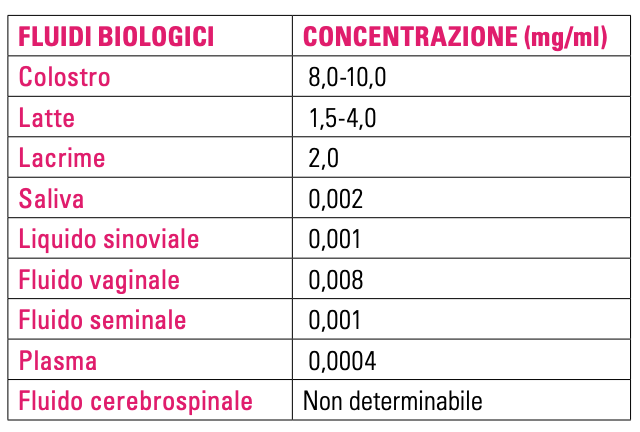
nelle secrezioni umane.
La concentrazione della Lf nelle secrezioni umane è riportata
nella tabella 2.
I granuli dei neutrofili, richiamati nei siti d’infezione e infiammazione, contengono la Lf ad una concentrazione totale di 15 µg
per 106 neutrofili (26).
Parimenti ad altre proteine o peptidi presenti nelle secrezioni, la
Lf è una glicoproteina multifunzionale. Le sue molteplici funzioni, dipendenti o indipendenti dalla sua capacità di chelare due
ioni ferrici per molecola, sono riassunte nella tabella 3.

È ben noto, inoltre, che la capacità dei batteri di colonizzare
l’ospite è criticamente dipendente dalla loro abilità di ottenere
adeguate quantità di nutrienti per la crescita. È di particolare
rilevanza per la salute umana comprendere come i batteri patogeni affrontino, durante l’infezione, il problema della limitazione di nutrienti nell’ospite, un ambiente dove alcuni elementi essenziali non sono disponibili per i microorganismi.
Tra questi elementi, il ferro è il più rappresentativo ed il più importante per lo sviluppo di tutte le cellule viventi ed in particolare per la virulenza microbica. Pertanto, i batteri patogeni competono con l’ospite per ottenere ferro sintetizzando delle piccole molecole (siderofori) ed i relativi recettori (18, 31, 32),oppure altri batteri patogeni, anaerobi facoltativi, come Porphyromonas gingivalis, acquisiscono il ferro direttamente dalla Lf o dall’eme (33, 34). Il risultato, quindi, della competizione tra la Lf ed il batterio per l’acquisizione del ferro (18) è considerato come uno dei più importanti fattori che consentono o meno la colonizzazione, la persistenza microbica nel cavo orale e la malattia. È stato anche riportato che il sovraccarico di ferro libero e disponibile nella saliva è critico per il passaggio dei batteri dallo stato planctonico a quello sessile in biofilm che caratterizza le infezioni orali pressoché ineradicabili (13). Inoltre, poiché il sovraccarico di ferro libero può essere osservato non solo nelle secrezioni, ma anche all’interno delle cellule dell’ospite, i batteri Gram-positivi aerobi intracellulari facoltativi, come Streptococcus mutans ed i batteri Gram-negativi anaerobi intracellulari facoltativi, come Prevotella intermedia, ne usufruiscono per aumentare la loro moltiplicazione e, quindi, la severità delle gengiviti e delle parodontopatie.
Il sovraccarico di ferro, nelle secrezioni o nei tessuti, caratterizza, quindi, lo stato patologico dell’ospite ed è dovuto:
- all’assenza o alla diminuzione della Lf nella saliva;
- al sanguinamento delle gengive che induce il rilascio dell’eme;
- ai processi infiammatori;
- ad una carenza di ferro in circolo.
Il sovraccarico di ferro libero ed emico, pertanto, concorre all’aumento della suscettibilità dell’ospite alle infezioni inducendo la moltiplicazione dei batteri extracellulari e a quella degli intracellulari facoltativi associati alle gengiviti e alle parodontiti.
L’assenza o la diminuzione della Lf nella saliva è correlata a carenze ormonali in quanto la sua sintesi è sotto il controllo degli estrogeni. Ne consegue che sia nelle donne in gravidanza che nella popolazione al di sopra dei 50 anni, la carenza di Lf nella saliva aumenta la suscettibilità dell’ospite a patologie infettive del cavo orale come alitosi, gengiviti e parodontiti.
Il sanguinamento delle gengive aumenta la concentrazione del
ferro emico derivante dalla digestione dell’emoglobina, prediletto sia dai microorganismi extra che intracellulari per la moltiplicazione e la colonizzazione dell’ospite.
Pertanto, è evidente che tutti questi disordini contribuiscono all’insorgere di processi infiammatori distruttivi provocati primariamente dalla carenza di Lf, ma anche dall’eccesso di ferro disponibile e dall’aumentata colonizzazione batterica.
Nella saliva umana, il contenuto di ferro (da 0,1 a 1,0 µM) può aumentare a causa del sanguinamento gengivale dovuto alle infezioni ed ai relativi processi infiammatori (13). Pertanto, la saliva rappresenta un modello interessante per studiare l’influenza della concentrazione di ferro e Lf sulle infezioni batteriche.
Infatti, il diverso rapporto tra ferro e Lf svolge un ruolo importante nello stile di vita di diversi batteri in quanto il ferro libero, dovuto alla completa saturazione in ferro della Lf, modula l’aggregazione e la formazione del biofilm. Una saliva con numerosi batteri in forma aggregata è tipica di soggetti senza carie, mentre quella con scarsi aggregati è tipica di soggetti con carie (13).
Inoltre, in pazienti affetti da gengivite e parodontite, l’elevata
concentrazione di ferro e la presenza di emina induce la moltiplicazione di microorganismi che, a loro volta, sintetizzano le proteasi con cui degradano la Lf (35, 36). La degradazione della Lf a causa delle proteasi batteriche potrebbe essere responsabile, in vivo, della ridotta o assente attività della Lf. Da quanto riportato, appare chiaro come sia essenziale ripristinare la
concentrazione di Lf integra attraverso la somministrazione di nuova Lf. Occorre, tuttavia, ricordare che i risultati sull’associazione tra la concentrazione della Lf nella saliva e le patologie microbiche del cavo orale possono essere influenzati dalla procedura sperimentale, dal flusso salivare, dalla presenza o assenza di ferro disponibile, dalla presenza di frammenti di Lf derivanti dalla digestione enzimatica batterica,
dall’età e dal sesso del soggetto e, pertanto, devono essere ben valutati.
Recentemente, per quanto concerne la carenza di ferro in circolo, Paesano e collaboratori (25) hanno dimostrato come la carenza di ferro in circolo non sia da associare ad una vera mancanza di ferro nell’organismo ma ad una sua delocalizzazione. In condizioni fisiologiche, il ferro giornalmente
viene assorbito dagli enterociti duodenali (1-2 mg/giorno) e sequestrato all’interno degli enterociti dalla ferritina. Non esistendo una via di escrezione, il fabbisogno di ferro è modulato dalla ferritina che, dopo averlo sequestrato, in caso di necessità, lo cede nuovamente alla cellula che lo esporta al circolo attraverso la ferroportina (Fpn), unica proteina in grado di esportare il ferro dalle cellule al circolo. Ogni giorno, inoltre, i macrofagi circolanti riciclano 20 mg di ferro derivante dalla lisi delle emazie senescenti attraverso il medesimo meccanismo descritto per gli
enterociti (fig. 10).
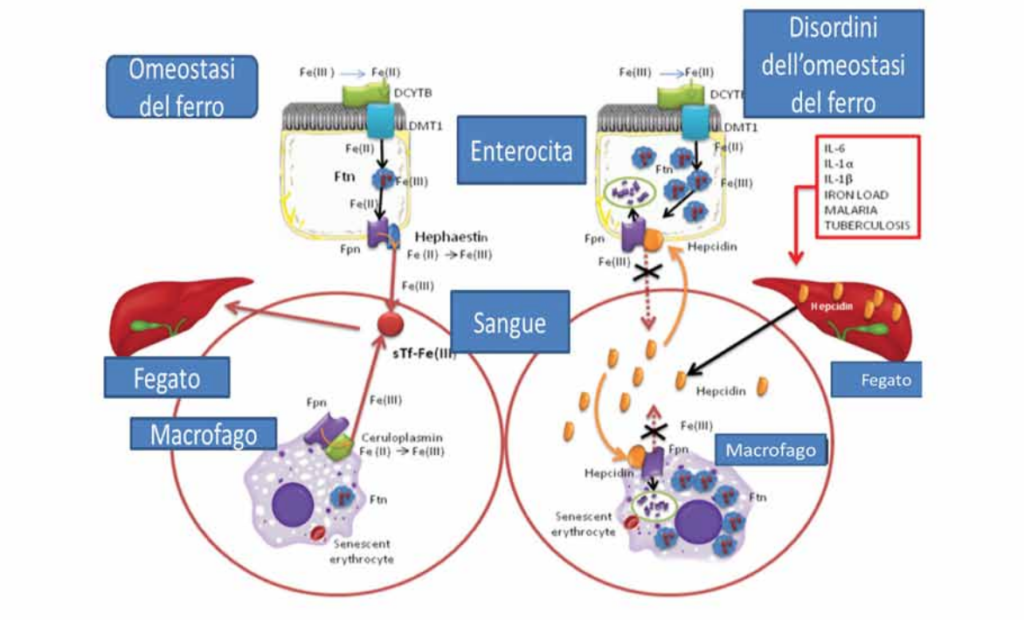
Omeostasi del ferro (fig. 10, pannello di sinistra): l’assorbimento del ferro avviene nel duodeno e include la riduzione del ferro dallo stato ferrico (III) a quello ferroso (II) da parte di una reduttasi (duodenal cytochrome B, DCYTB); successivamente, lo ione ferroso penetra all’interno della cellula attraverso Divalent Metal Transporter 1 (DMT1). Il ferro assorbito viene sequestrato dalla ferritina (Ftn) e, dopo rilascio dalla Ftn, viene esportato nel circolo dalla ferroportina (Fpn). La Fpn agisce insieme all’efestina che ossida il ferro ferroso a ferro ferrico per facilitarne il legame con la transferina in circolo. La Fpn è stata trovata anche nei macrofagi dove gioca un ruolo nell’esportare il ferro al circolo supportata dalla ceruloplasmina che, similmente all’efestina, ossida gli ioni ferrosi (25).
Questo meccanismo di esporto o accumulo sistemico del ferro è
posseduto anche da altre cellule inclusi gli epiteli a livello delle
mucose orali (fig. 11).
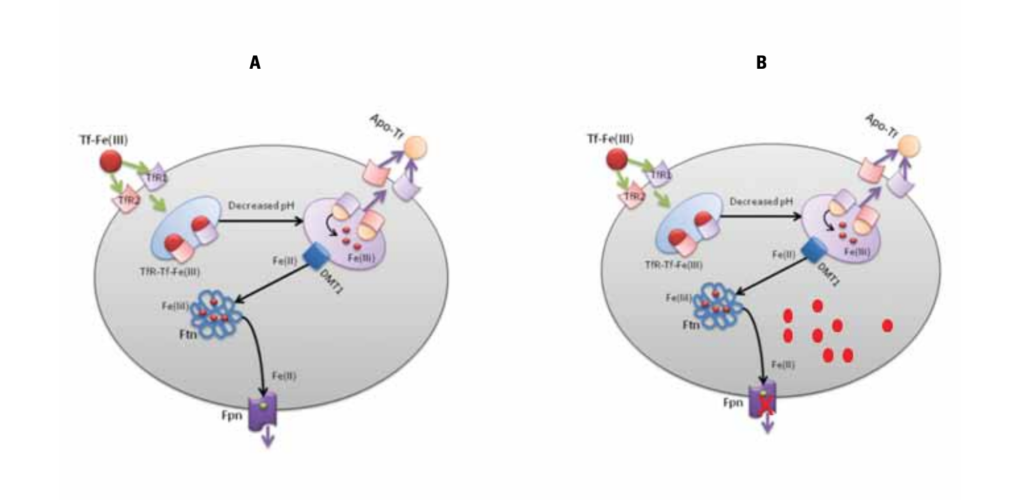
dove la Fpn è inibita ed il ferro libero ( ) è presente in eccesso.
Da quanto riportato, è ovvio che l’accumulo di ferro, nelle cellule e secrezioni, che facilita la colonizzazione batterica, il processo infiammatorio ed il danno cellulare, sia dovuto alla inibizione della sintesi della Fpn. In assenza di Fpn, il ferro non può essere esportato e resta accumulato all’interno della cellula. Inoltre, la sintesi della Fpn è sotto il controllo della citochina pro-infiammatoria IL-6. L’aumento della concentrazione di IL-6 e quindi l’instaurarsi di un’infiammazione patologica nelle secrezioni, inibisce, quindi, la sintesi della Fpn, inducendo l’accumulo di ferro nei tessuti/secrezioni e, parallelamente, la sua carenza in circolo (25, 26).
Il ripristino della concentrazione della Lf nella saliva attraverso una o più somministrazioni al giorno di 50 mg di Lf, diminuisce la sintesi dell’IL-6, induce nuovamente la sintesi della Fpn ed il conseguente export del ferro dalle cellule al circolo. In altre parole, la Lf previene e cura l’infiammazione, principale causa del sovraccarico di ferro e delle infezioni nelle mucose, rispristinando così la sintesi della Fpn e annullando i disordini dell’omeostasi del ferro (37, 38).
Infiammazioni ed Infezioni del Cavo orale
Prima di procedere alla disamina delle infezioni e patologie del
cavo orale, va ricordata la peculiarità di questo particolare habitat dove sono presenti contemporaneamente superfici abiotiche e biotiche irrorate da una secrezione, la saliva, fondamentale per la sua salute. Altra peculiarità è rappresentata dalla presenza di microorganismi commensali che, sin dalla nascita, colonizzano le mucose e dopo l’eruzione colonizzano anche i denti.
Le superfici cellulari (epiteli a livello delle mucose) e quelle abiotiche (denti) sono permenentemente colonizzate da microorganismi commensali adesi, aggregati e in biofilm (placca microbica) ed irrorate dalla saliva composta in massima parte da acqua (98%) ed in misura minore (mM) da elettroliti, proteine, glicoproteine ed enzimi.
Nei soggetti sani, la presenza di commensali previene l’adesione e la colonizzazione di patogeni e la presenza di saliva, mediante il lisozima, la lattoferrina, la lattoperossidasi, lo ione tiocianato e gli anticorpi secretori, svolge un’azione antibatterica e antimicotica. I commensali, inoltre, restano adesi alle mucose, non sono in grado di entrare all’interno delle cellule dell’ospite e non inducono fenomeni infiammatori.
Pertanto, le patologie del cavo orale insorgono a seguito di disordini e cambiamenti non solo della composizione della placca microbica ma anche dei componenti della saliva, inclusi soprattutto i componenti con attività antimicrobica, un’efficace barriera contro la colonizzazione di batteri patogeni.
Ne consegue che nelle patologie orali, la barriera dei batteri
commensali è danneggiata e pertanto permissiva alla colonizzazione di batteri patogeni che, per non competere con i commensali e con i fattori dell’immunità naturale, penetrano all’interno della cellule ospite, nicchia privilegiata per replicarsi, inducendo una risposta infiammatoria da parte degli epiteli a livello delle mucose.
Inoltre, come già detto, i microorganismi necessitano di ferro per la crescita, la proliferazione, la replicazione del DNA e la produzione
di energia. Tuttavia, il ferro può essere tossico quando è presente in eccesso a causa della sua capacità di donare elettroni all’ossigeno, causando la formazione di radicali tossici dell’ossigeno (ROS) che inducono un danno alle cellule e ai loro propri componenti incluso il DNA, le proteine e le membrane lipidiche. Questa dicotomia ha portato all’evoluzione di sofisticati controlli del metabolismo del ferro, attualmente denominato omeostasi del ferro, che vanno da quelli presenti nei tessuti e secrezioni fino a quelli nel circolo (figg. 10 e 11).
Dal momento che i microorganismi necessitano di ferro libero
per moltiplicarsi, colonizzare e persistere nell’ospite, in situazioni fisiologiche, nei tessuti e secrezioni la concentrazione di ferro libero e disponibile (non legato a composti organici) è pari a 10-18 M, molto lontana da quella necessaria alla crescita microbica, all’induzione di specie reattive dell’ossigeno (ROS) e alla conseguente infiammazione.
In situazioni patologiche, invece, il ferro libero e disponibile nei
tessuti e secrezioni è pari a circa 100 µM, sufficiente alla moltiplicazione batterica, alla formazione di ROS e all’induzione in situ ed in circolo di un processo infiammatorio che consiste nella produzione, da parte degli epiteli delle mucose, di elevati livelli di citochine proinfiammatorie. È ormai appurato che l’elevata concentrazione di ferro disponibile causa processi infiammatori. In particolare, elevati livelli di IL-6, citochina proinfiammatoria, modulano negativamente la ferroportina (Fpn), l’unica proteina in grado di esportare il ferro dalle cellule e dalle secrezioni
al circolo (25). Ne consegue che disordini nell’omeostasi del ferro ed in particolare l’inibizione della sintesi della Fpn portano ad un dannoso accumulo di tale elemento nelle cellule e nelle secrezioni dove favorisce lo sviluppo microbico extra e intracellulare, la formazione dei ROS ed il danno cellulare associato ad una infiammazione patologica distruttiva.
Pertanto, il primo segnale, nelle fasi precoci delle patologie orali, è rappresentato dall’infiammazione del cavo orale, associata
nella maggior parte dei casi ad un’infezione dovuta a batteri, miceti e virus.
Il genere batterico più comunemente associato alle infezioni del
cavo orale è Streptococcus spp. La cavità orale del neonato, alla
nascita, non contiene microorganismi, ma rapidemente e primariamente viene colonizzata da batteri come Streptococcus salivarius. All’apparire dei denti, durante il primo anno, la colonizzazione della superficie dentale e della gengiva avviene ad opera di Streptococcus mutans e Streptococcus sanguinis. La zona gengivale, successivamente, diverrà l’habitat ideale per batteri anaerobi appartenenti ai generi Bacteroides e Spirochetes, generalmente associati alle parodontopatie (39). Il microbiota orale include anche Lactobacilli, Staphylococci, Corynebacteria.
Altri generi batterici possono causare delle severe
patologie ed in particolare:
- Mycobacterium tuberculosis, proveniente dall’espettorato polmonare, può provocare delle ulcerazioni nel cavo orale;
- Treponema pallidum, agente eziologico della sifilide, può determinare una lesione primaria che, se non trattata, può determinare lesioni mucose secondarie e una gomma terziaria;
- Neisseria gonorrhoeae produce bruciore e ulcerazioni della gengiva e della lingua, unitamente ad una faringite;
- Actinomyces spp, anche se appare come un’infezione fungina, in realtà è batterica e produce nell’essudato purulento granuli gialli (“sulfurei”) patognomonici;
- Fusospirochete provocano la stomatite gangrenosa che provoca a sua volta una distruzione grave dei tessuti gengivali in pazienti immunodepressi;
- Veillonella, cocco anaerobio Gram-negativo, è resistente al pH acido dell’habitat dove si sviluppano le carie e sembra possa rallentare lo sviluppo della carie dentale, convertendo i prodotti acidi in altri composti organici;
- Actinobacillus actinomycetemcomitans è associato alla parodontite aggressiva giovanile;
- Lactobacillus spp, pur essendo in genere commensali, possono essere associati alla carie dentale.
Nel microbiota di soggetti sani, è in genere presente anche Candida albicans, che, tuttavia, a seguito di prolungati trattamenti con antibiotici o chemioterapici, può provocare una candidosi che si manifesta con granuli biancastri superficiali che, se rimossi, lasciano una superficie infiammata e sanguinante. Le lesioni orali e periorali, associate ad altri miceti come la blastomicosi, l’istoplasmosi, la coccidioidomicosi, la criptococcosi
(soprattutto nei pazienti debilitati) e la mucormicosi si verificano raramente.
Le infezioni virali del cavo orale sono, invece, abbastanza frequenti. Le infezioni da Herpesvirus sono tra le più comuni, mentre altre, clinicamente significative, si osservano soprattutto nelle persone immunocompromesse.
Le infezioni microbiche del cavo orale provocano alitosi, gengiviti e parodontiti.
Alitosi
Per alitosi si intende un odore sgradevole emesso durante la respirazione da un soggetto di ogni sesso ed età. La sua frequenza, in genere, aumenta con l’aumentare dell’età.
Quando il cattivo odore origina direttamente dal cavo orale, esso è in genere dovuto alla presenza di residui di cibo che vengono utilizzati dai batteri della placca presenti ad elevata concentrazione a causa di una scarsa igiene orale, di una scarsa salivazione, di un particolare microbiota linguale, di carie non individuate, di infezioni locali, di gengive infiammate a causa di gengiviti e parodontiti, di protesi incongrue e del consumo di bevande alcooliche. L’alitosi può anche essere dovuta al tabagismo e al consumo abituale di cibi alitogeni come aglio e cipolla, ma in tal caso essa è riconoscibile perché transitoria e non permanente.
Inoltre, nell’alitosi, la superficie linguale, a causa delle numerose papille presenti, rappresenta la riserva ottimale per gli anaerobi Gram-negativi
facoltativi o obbligati che producono composti volatili solforati a
causa della loro attività proteolitica.
Per maggiori dettagli consultare l’articolo “Lattoferrina e alitosi.
Patologie del cavo orale: terapie classiche e innovative nella cura
dell’alitosi”.
Gengiviti
La gengivite è un disturbo a carattere infiammatorio che interessa il tessuto gengivale. Per gengivite si intende, quindi, infiammazione dei tessuti gengivali, caratterizzata da gonfiore, arrossamento, calore e sanguinamento conseguenti all’accumulo di placca.
La malattia è reversibile dopo la rimozione delle cause responsabili. Tutte le specie batteriche che compongono la placca, depositandosi sulle superfici dure del dente, possono causare la gengivite. Pertanto, l’assenza di igiene orale e l’accumulo della placca possono favorire l’insorgere della gengivite,
anche se anomalie morfologiche o strutturali dei denti, fratture
radicolari e ricostruzioni dentali incongrue non possono essere
escluse come agenti causali.
L’importanza dei livelli degli androgeni, estrogeni e progesterone
durante la pubertà e durante la gravidanza sono stati associati alle gengiviti e ai fenomeni infiammatori ad essi associati a causa della diminuzione nella saliva di importanti componenti, come la lattoferrina, che sono sintetizzati sotto il controllo ormonale.
Anche la malnutrizione è una delle cause di gengiviti nei paesi in via di sviluppo: in particolare la carenza di vitamina C che porta allo scorbuto, ma anche di vitamina A, B2 e B12, favorisce
la gengivite.
In sintesi, le gengiviti sono caratterizzate da flogosi dei tessuti molli peridentali, rossore, edema, sanguinamento, alterazione del contorno gengivale, incremento di flusso del fluido crevicolare ed accumulo della placca batterica con conseguente alterazione patologica dei tessuti, senza perdita dell’attacco del dente.
Per maggiori dettagli si rimanda all’articolo: “Lattoferrina e gengiviti. Patologie del cavo orale: terapie classiche ed innovative
nella cura delle gengiviti”.
Parodontiti
Si definiscono parodontiti le patologie che insorgono quando
l’infiammazione si estende al di là delle gengive per raggiungere le strutture interne di sostegno del dente che, in una prima fase, inizia a muoversi e, successivamente, perde completamente l’attacco.
Le parodontiti risultano reversibili se vengono diagnosticate
nelle prime fasi e curate immediatamente. Con il progredire della malattia, testimoniata principalmente come progressione della perdita di attacco del dente, la possibilità di recupero diventa più difficile, generalmente parziale e richiede trattamenti più complessi fino alla terapia rigenerativa dell’osso.
Per maggiori dettagli si rimanda all’articolo “Lattoferrina e parodontopatie. Patologie del cavo orale: terapie classiche ed innovative nella cura delle parodontopatie”.
Lattoferrina e Cavo Orale
Ultimi Articoli
Vuoi saperne di più sui nostri prodotti?
Vuoi saperne di più sui nostri prodotti?
Cookie Policy | Privacy policy | Privacy Uragme
Web site design, testi e grafica © ForhansLattoferrina 2020 - P. Iva 00884231002 - Powered to: THE DIGITAL WORLD



